Por: Nina Padme Eufracio Rojas / Departamento de Químico en Fármacos. Centro de Enseñanza Técnica Industrial Plantel Colomos. C. Nueva Escocia 1885., 44630 Guadalajara, Jal. Correo : neufraciorojas@gmail.com / Instagram:@ninapadme
En la Tierra, cuando se desea que dos moléculas se unan, lo habitual es ayudarlas. Un disolvente que las acerque. Un catalizador que active sus enlaces. Calor que las agite. Pero ¿qué ocurre cuando no hay nada de eso? Ni presión, ni disolvente, ni calor añadido. Solo vacío, radiación ultravioleta y moléculas flotando en la oscuridad. La respuesta sorprendente es que aun así, en ese silencio químico, las reacciones pueden ocurrir. Y entre las más fascinantes están las reacciones pericíclicas.
Las reacciones pericíclicas son como coreografías moleculares. No implican ruptura abrupta de enlaces, ni la formación intermedia de iones o radicales. Ocurren en un solo paso, como un paso de baile colectivo, donde los electrones se mueven simultáneamente y en sincronía. Entre ellas se encuentran procesos clave como la reacción de Diels–Alder, la cicloadición [4+2] que forma anillos de seis átomos en una sola jugada orbital.
En el laboratorio, estas reacciones requieren temperaturas moderadas o la presencia de luz para activarse. En el espacio, la temperatura puede ser de apenas 10 kelvins. Pero hay un ingrediente que sí abunda: radiación ultravioleta, especialmente en regiones como nubes moleculares interestelares, zonas oscuras y densas donde el polvo y el gas se acumulan en espera de formar nuevas estrellas.
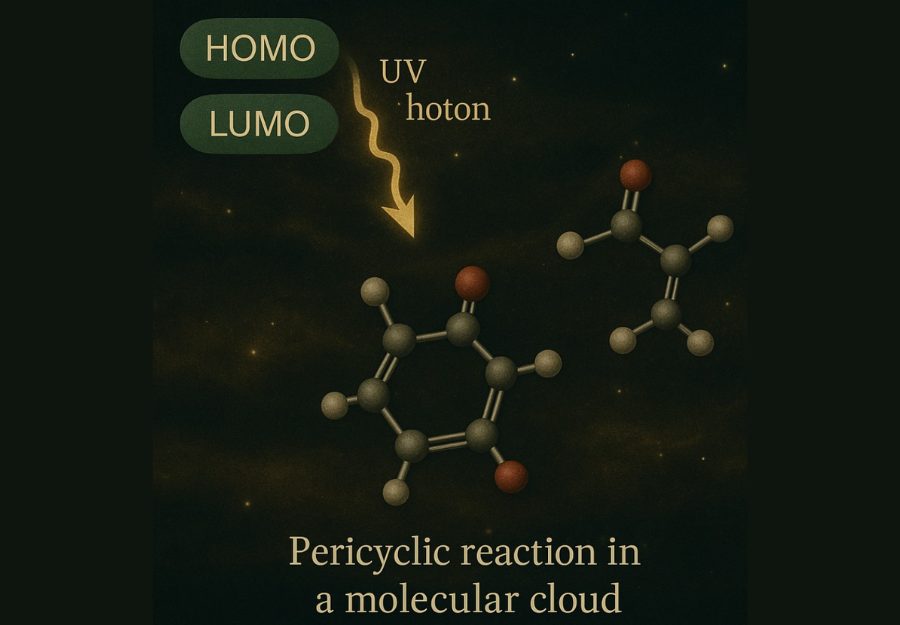
Aquí es donde entra el verdadero truco cuántico: cuando una molécula absorbe un fotón UV, su sistema electrónico puede reconfigurarse momentáneamente. Esto altera la ocupación de orbitales moleculares. En otras palabras, la distancia energética entre el HOMO (Highest Occupied Molecular Orbital) y el LUMO (Lowest Unoccupied Molecular Orbital) se reduce, facilitando el acoplamiento electrónico necesario para que la reacción ocurra.
Este emparejamiento orbital, conocido como orbitopar simétrico, permite que los electrones compartidos se deslicen de un enlace a otro sin romper la continuidad de la molécula. Todo sucede sin intermediarios, sin colisiones violentas, sin solventes que amortigüen. Solo el fotón, la geometría molecular y la alineación orbital perfecta.
Un ejemplo fascinante es la posibilidad de que dos moléculas pequeñas como el butadieno y el etileno se unan en el espacio mediante una reacción Diels–Alder inducida por UV, formando estructuras cíclicas prebiológicas. Simulaciones computacionales muestran que estas reacciones pueden ocurrir en escalas de tiempo largas, donde la radiación cósmica juega el papel de energía activadora intermitente pero suficiente.
Es como si, en vez de usar herramientas, las moléculas siguieran una partitura electrónica. No necesitan empujones. Solo el momento justo en que su música interna se alinea con la energía del universo.
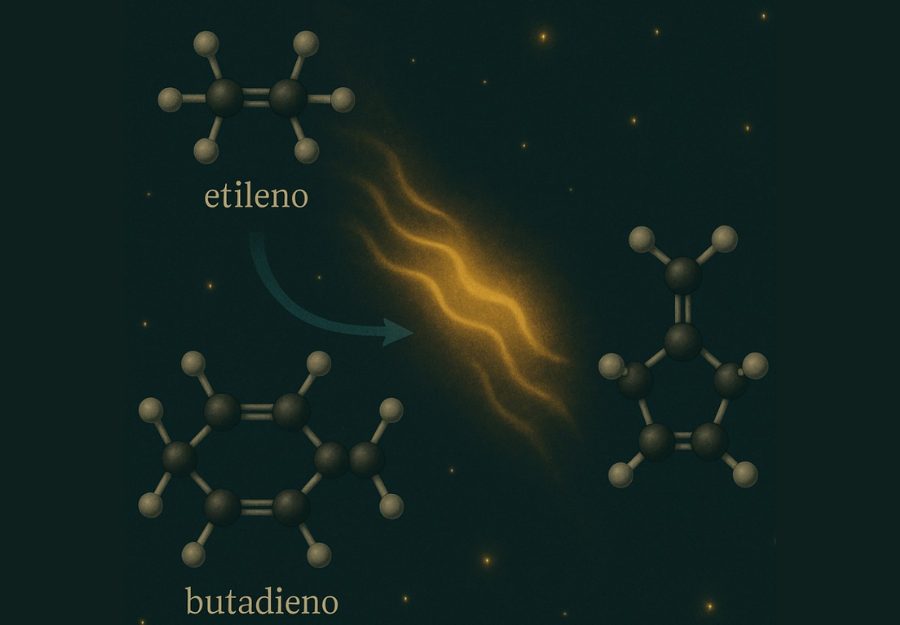
La ausencia de presión no impide que se acerquen, porque las trayectorias libres en el vacío son largas y las velocidades moleculares bajas, lo que da lugar a encuentros lentos pero prolongados. Y una vez que están frente a frente, si el orbital de cada una está en fase con el otro, pueden reorganizarse elegantemente en una nueva estructura, sin necesidad de ayuda externa.
Estas reacciones no son sólo un experimento mental. Se han detectado compuestos cíclicos complejos en meteoritos carbonáceos y en el polvo interestelar que no podrían explicarse por reacciones radicalarias o colisiones iónicas. La hipótesis más elegante es que reacciones pericíclicas como la Diels–Alder podrían estar ocurriendo desde hace miles de millones de años en el vacío cósmico.
La química, entonces, no solo ocurre en matraces y tubos de ensayo. También ocurre flotando, lentamente, en la quietud del espacio. Lo que parecía imposible —una reacción sin catalizador ni solvente— resulta ser no solo posible, sino natural.
Referencias
- Ehrenfreund, P., & Charnley, S. B. (2000). Organic molecules in the interstellar medium, comets, and meteorites: A voyage from dark clouds to the early Earth. Annual Review of Astronomy and Astrophysics, 38, 427–483. https://www.annualreviews.org/doi/10.1146/annurev.astro.38.1.427
- García-Ruiz, J. M., Hyde, S. T., Carnerup, A. M., Christy, A. G., Van Kranendonk, M. J., & Welham, N. J. (2003). Self-assembled silica–carbonate structures and detection of microbial life. Science, 302(5648), 1194–1197. https://www.science.org/doi/10.1126/science.1085922
- Kaiser, R. I. (2002). Experimental investigation on the formation of polycyclic aromatic hydrocarbons in extraterrestrial environments. Chemical Reviews, 102(5), 1309–1358. https://pubs.acs.org/doi/10.1021/cr970004v
- Saladino, R., Botta, G., Bizzarri, B. M., & Di Mauro, E. (2018). Prebiotic chemistry and the origin of life: A critical overview. Genes, 9(2), 72. https://www.mdpi.com/2073-4425/9/2/72
- Tielens, A. G. G. M. (2013). The molecular universe. Reviews of Modern Physics, 85(3), 1021–1081. https://journals.aps.org/rmp/abstract/10.1103/RevModPhys.85.1021
